tRNA疗法可以帮助恢复翻译中丢失的蛋白质 一类基于转移 RNA 的新疗法可以治疗囊性纤维化、肌肉萎缩症、遗传性癫痫等形式
简单来说超过 10% 的遗传疾病是由阻止细胞制造完全形成蛋白质的突变引起的。一种使用抑制转移 RNA (tRNA) 的实验性疗法可以帮助覆盖这些突变并恢复正常的蛋白质生产。尽管这项技术可以追溯到近 40 年前,但生物技术公司终于开始认真对待这个想法,基于 tRNA 的疗法正在开发中,用于治疗囊性纤维化、Dravet 综合征、杜氏肌营养不良症和 Rett 综合征。但要取得成功,这些疗法需要克服所有 RNA 分子共有的药物输送挑战和 tRNA 特有的安全问题。 |
当 Daniel Fischer 在 2017 年共同创立 Tevard Biosciences 时,他并没有试图押注下一个热门的 RNA 技术。他的兴趣更个人化。他的女儿娜塔莎患有Dravet 综合征,这是一种罕见的癫痫症,由一种钠通道的遗传故障引起。这种蛋白质传导脑细胞用来交流的电信号。多年来,这个小故障每天晚上都折磨着娜塔莎,小规模癫痫发作超过 40 次。Fischer 和他的妻子轮流陪着她。“我们没有睡觉,”他说。
几种药物有助于减少 Natasha 癫痫发作的频率,但她的疾病对她的认知和身体造成了伤害。Fischer 毕生致力于为 Dravet 寻找治疗方法。他探索了使用基因治疗或基因编辑的可能性——这些技术因其解决其他罕见遗传疾病的能力而占据头条新闻。但科学家告诉他,这些方法对于 Dravet 来说很难实施。相反,一种称为转移 RNA (tRNA) 疗法的新奇想法似乎可能就是答案。
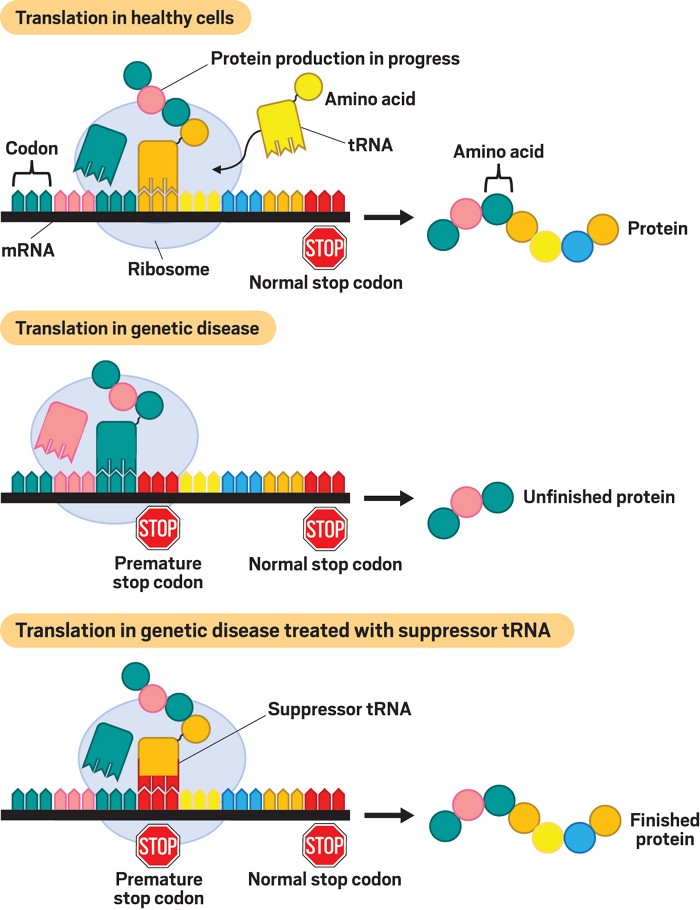
正如生物学家所知,转移 RNA 或 tRNA 通过翻译信使 RNA (mRNA)的核苷酸代码帮助细胞从氨基酸组装蛋白质。每个 tRNA 分子读取称为密码子的三个核苷酸,它代表将特定氨基酸添加到蛋白质的指令。然后,tRNA 通过将相应的氨基酸转移到细胞的蛋白质制造机器(称为核糖体)而得名。这个过程沿着 mRNA 链的长度重复,直到核糖体遇到终止密码子,这是一种特殊的三重核苷酸,标志着蛋白质制造说明手册的结束。核糖体的工作完成了。
无论如何,这就是它应该工作的方式。但有时,基因突变会导致将一个密码子更改为另一个密码子的错别字,促使 tRNA 添加错误的氨基酸——这导致蛋白质完全形成但并不总是正常运作。也可能发生更严重的错误。大约四分之一的 Dravet 患者,包括 Natasha,有一种导致过早终止密码子的突变,就像一个错位的句号打断了句子的中间。tRNA 不与它们结合,当 Natasha 的核糖体遇到这些错位的时期时,它们错误地认为自己已经完成了钠通道的构建,在原位留下了大量氨基酸。
现在,包括 Fischer 共同创立的那家生物技术公司在内的少数生物技术公司正在研究称为抑制 tRNA 的疗法,该疗法可以覆盖像 Natasha 细胞中的过早终止密码子。这个想法是创造与那些错误代码结合的分子,并提供应该进入蛋白质那部分的氨基酸。这样做应该能让 Natasha 的核糖体完成整个钠通道的形成并纠正她神经元中电信号的平衡。
尽管 Fischer 对抑制 tRNA 的兴趣仍然非常个人化,但自从共同创立 Tevard 以来,他对该技术可以实现的目标的愿景已经大大扩展。过早终止密码子导致超过 10% 的遗传疾病,包括某些类型的囊性纤维化和杜氏肌营养不良症。Fischer 认为,如果一种基于抑制性 tRNA 的药物可以平息 Natasha 的癫痫发作,那么同样的药物可能会治疗其他癫痫,甚至是由同一种过早终止密码子引起的不同遗传疾病,无论密码子出现在哪个基因中。
尽管有希望,但抑制性 tRNA 疗法并不确定。对于任何 RNA 分子来说,药物递送仍然是一个挑战,开发人员需要证明他们的抑制性 tRNA 不会干扰正常基因并刺激核糖体产生潜在的有毒蛋白质。
好消息是,这些挑战似乎比以往任何时候都更容易克服。Moderna和辉瑞都通过其成功的COVID-19疫苗和他们使用的脂质纳米颗粒递送技术证明了 RNA 的价值。约翰霍普金斯大学分子生物学家雷切尔格林说:“这一年突然间,我们向细胞输送 RNA 的潜力变得更加清晰,”tRNA 看起来是一个很好的尝试。“但任何研究核糖体的人都会说,‘好主意。现在告诉我你可以做到。”
通过停车标志
改造 tRNA 来治疗遗传疾病的想法已经存在了近 40 年——几乎与科学家们了解这种分子的时间一样长。但直到最近,抑制性 tRNA 疗法几乎没有引起学术界的兴趣,几乎没有来自生物技术公司的投资。相反,该行业长期以来一直专注于通过替换或修复 DNA 来治愈遗传疾病。
以 Dravet 为例。SCN1A(编码关键钠离子通道的基因)的调控受到严格控制。导致产生过多蛋白质的基因疗法可能与产生过少蛋白质的突变一样危险。Fischer 说,即使基因疗法可以达到适当的平衡,还有一个更直接的障碍:SCN1A太大而无法装入目前用于提供基因疗法的工程病毒中。这种包装问题适用于许多其他罕见疾病背后的错误基因,如囊性纤维化和肌肉萎缩症。
CRISPR 基因编辑也具有与基因治疗相同的包装尺寸限制,并存在对 DNA 进行永久性问题更改的风险。在2017年,PRASHANT马里在加州圣地亚哥大学实验室发布的早期作品描述抑制tRNA和另一种技术叫做RNA编辑怎么可能是从一个科学家,谁在2013年成为了“基因组瘢痕”替代基因编辑,一个大胆的要求之间的第一个在实验室中在人体细胞上测试 CRISPR。
“CRISPR 不会对所有事情都有好处,”Shape Therapeutics 的研究主管 David Huss 说,该公司于 2018 年在马里的工作基础上成立。“我们需要更加开放地寻找最适合每种疾病的方法。”
随着投资者越来越关注基因治疗和基因编辑的潜在局限性,不影响 DNA 及其微调监管的竞争技术开始开辟出一个利基市场。“tRNA 方法保持了基因组中所有微妙之处的完整性,并且只是解决了所有监管下游的问题,”投资 Shape 的风险投资公司 Mission BioCapital 的合伙人 Robert Blazej 说。这家初创公司现在正在开发抑制性 tRNA 来治疗称为雷特综合征的神经发育障碍,其中约 30% 的病例是由过早终止密码子引起的。
大约在 Shape 开始实施的同时,德克萨斯农工大学和德克萨斯大学西南医学中心的四位科学家正在开发一种抑制 tRNA 疗法,用于治疗由过早终止密码子引起的囊性纤维化。这些突变约占囊性纤维化病例的 10%,包括无法用现有小分子药物治疗的病例。这项工作成为 ReCode Therapeutics 的基础。“这是一个令人兴奋的新途径,以前没有人做过,而且它真的是开箱即用的,”帮助资助 ReCode 的囊性纤维化基金会的首席科学官威廉斯卡赫说。与此同时,Fischer 正忙于与私人投资者 Warren Lammert 共同创立 Tevard,后者的女儿也有 Dravet,以及 Harvey Lodish,
为了制造他们的抑制性 tRNA 疗法,这些公司必须首先了解正常 tRNA 的工作原理。这些分子由 RNA 链制成,RNA 链的长度通常为 70 到 80 个核苷酸——与 COVID-19 疫苗中每条 mRNA 链中的数千个核苷酸相比,一口大小。更重要的是,mRNA 是一种信息分子,而 tRNA 是一种作用分子。
tRNA 链扭曲成 3D 结构,从某个角度看起来像佛罗里达州。当 tRNA 的南端(称为反密码子)与 mRNA 上的相应密码子配对时,tRNA 的狭长柄将氨基酸转移到核糖体。反密码子是科学家在制造抑制性 tRNA 时修补的主要位点。尽管 tRNA 通常不会与终止密码子结合,但科学家们可以简单地改变反密码子中的一到三个核苷酸,以制造出能够结合的合成版本。“它们制作起来很简单,”Lodish 说。
例如,密码子 CGA 指示 tRNA 将氨基酸精氨酸转移到核糖体。一种常见的基因突变将 CGA 转化为 UGA,将精氨酸密码子转变为过早的终止密码子。通过设计与 UGA 结合并将精氨酸转移到核糖体的抑制性 tRNA,这些公司希望覆盖错误的停止信号并允许制造其余的蛋白质。“核糖体像没有发生任何奇怪的事情一样不停地运转,”Shape Therapeutics 的 Huss 说。
我们的身体有数百种不同的 tRNA,每一种都致力于转移用于构建人类蛋白质的 20 种氨基酸中的一种。为什么,确切地说,我们需要这么多 tRNA 仍然有点神秘,但它为抑制 tRNA 开发人员提供了很多探索的领域。2019 年,爱荷华大学的 Christopher Ahern 和他的一位前博士后研究人员 John Lueck 发表了一项研究结果,该研究使用这些天然 tRNA 作为设计和测试数百种抑制性 tRNA 的基础。“每个 tRNA 家族都有很多失败者,也有一些成功者,”Lueck 说,他现在正在罗切斯特大学医学中心自己的实验室研究这种方法。
Tevard 获得了学术团队的抑制 tRNA 的许可,并在含有 Natasha 过早终止密码子的细胞中测试了一种有前景的 tRNA。“没有抑制 tRNA,什么也做不成,”Lodish 说。“如果你加入抑制 tRNA,你就会得到一个全长蛋白质。” 更重要的是,细胞的电读数显示,由此产生的钠通道打开和关闭,就好像从来没有发生过突变一样。“这是完全正常的,”洛迪什说。
同样的抑制 tRNA 也可以用于其他应用。“任何精氨酸到 UGA 的突变都可以被这些 tRNA 逆转,”Lodish 说。这是开发抑制性 tRNA 公司的一个关键卖点:与基因治疗和基因编辑不同,基因治疗和基因编辑必须针对特定基因和特定疾病进行设计,tRNA 疗法可以对许多患有由相同类型早产引起的疾病的人有效终止密码子。
精氨酸到 UGA 的转换以及其他两个突变占由过早终止密码子引起的所有已知疾病的近一半。Tevard 正在将所有三种抑制性 tRNA 结合到一种名为 Tristop 的单一疗法中,它认为这种疗法至少可以治疗由过早终止密码子引起的所有杜氏肌营养不良症病例的三分之二。联合方法将使设计可用于广泛患者的单一疗法变得更容易,但该策略也增加了副作用的风险。该公司现在正在用 Duchenne 在老鼠身上测试 Tristop,并正在与专注于肌肉萎缩症的大公司讨论合作该技术。
Tevard 也处于开发一种完全不同的策略的早期阶段,它称之为增强子 tRNA 疗法。虽然抑制 tRNA 旨在从有缺陷的基因中恢复蛋白质生产,但增强 tRNA 疗法可以帮助患有一类由突变驱动的疾病的人的蛋白质产量翻倍,这使他们只能制造所需蛋白质的一半,杰夫科勒解释说,RNA约翰霍普金斯大学的科学家帮助测试了这种方法。Tevard 正在与癫痫药物公司 Zogenix 合作,研究 Dravet 和其他癫痫的抑制和增强 tRNA。
翻译的挑战
抑制性 tRNA 疗法的潜在优势取决于开发它们的公司的两个坚定信念:首先,这些合成分子将是安全的,其次,科学家们将能够使用一些相同的技术将它们输送到体内基因疗法和mRNA疫苗是基于。两者都不是给定的。
长期以来,安全问题一直是开发抑制性 tRNA 的智力障碍。科学家们不确定抑制性 tRNA 是否只会与它们的预期目标配对——那些过早的终止密码子——或者它们是否也可能与正常的终止密码子结合。毕竟,在 Dravet 综合征的过早终止密码子中发现的 UGA 序列与在数千个其他 mRNA 的正常终止密码子中发现的三个核苷酸相同。结果可能是将氨基酸序列附加到其他正常蛋白质的末端。
ReCode 的联合创始人、德克萨斯 A&M 的名誉教授 Arthur Johnson 说:“人们会认为抑制性 tRNA 真的会搞砸细胞。” “但事实并非如此。”

一种称为核糖体分析的技术有助于解释原因。该方法使科学家能够对在任何给定时间沿着 mRNA 链移动并在我们的细胞中制造蛋白质的数千个核糖体进行快照。科学家们将核糖体冻结在他们的轨道上,降解核糖体没有主动读取的所有 mRNA,然后分离并测序留下的 mRNA 小片段。Rochester 的 Lueck 说,该结果让科学家们了解核糖体正在读取什么,以及它们是否错误地掠过终止密码子。
在正常细胞中的实验表明,错误在某种程度上是常见的。大约 1% 的时间里,核糖体可能会不恰当地读取终止密码子。Ahern 和 Lueck 与囊性纤维化基金会的科学家合作,对其抑制基因 tRNA 进行了核糖体分析研究。总的来说,该团队发现他们的大多数分子并没有比正常情况更容易忽略终止密码子。“这是我们遇到的最令人惊讶、最有用和最意外的结果之一,”Ahern 说,称其为该技术的“谜团之一”。这也是一个关键的卖点。“如果没有这些数据,这些生物技术公司可能永远不想接触它,”他说。
科学家们欣然承认,他们并不完全理解为什么抑制性 tRNA 似乎有利于过早的终止密码子。但他们认为,正常终止密码子的上下文而不是其特定的核苷酸三重奏很重要。Ahern 说,正常的终止密码子及其周围的 mRNA 序列会吸引有助于降低翻译速度的分子。在核糖体确实潜入正常终止密码子的情况下,我们的细胞具有用于降解产生的蛋白质的后备系统。
这些后备系统并不意味着公司可以保证抑制 tRNA 的安全。只有临床试验才能证明这一点。约翰霍普金斯大学的格林,其实验室专门研究翻译,他说这些分子有可能触发核糖体读取核糖体分析实验无法检测到的 mRNA 链上的终止密码子。
一些 tRNA 工程可以帮助缓解一些安全问题。汉堡大学 tRNA 科学家 Zoya Ignatova 说,她改变了 tRNA 反密码子环的大小,使分子优先结合过早终止密码子而不是常规终止密码子。她正在申请的这项技术专利被转让给了 mRNA 治疗公司 Arcturus Therapeutics。她认为修补 tRNA 结构的其他部分也有助于使分子成为更好的药物。
安全性并不是 tRNA 领域唯一的未知数。当投资者问 ReCode 的 Lockhart 为什么以前没有人尝试开发抑制性 tRNA 疗法时,他指的是交付。洛克哈特说,任何人都可以让这些分子在培养皿中发挥作用,但让足够数量的功能性 tRNA 进入体内完全是另一回事。公司专注于解决这一递送问题的两种方法:将合成的 tRNA 分子包装在脂质纳米颗粒中,或编码用于在工程病毒(如腺相关病毒 (AAV))中制造 tRNA 的遗传指令。
Shape 和 Tevard 都在使用 AAV 将抑制 tRNA 的基因传递到细胞中,这种方法基本上创造了一种一次性的基因疗法。当病毒进入人体细胞时,用于制造抑制性 tRNA 的 DNA 编码指令链将使他们能够维持这些 tRNA 的稳定、潜在的永久供应。
与此同时,ReCode 正在使用 UT 西南化学家 Daniel Siegwart 的技术将其化学合成的 tRNA 包装成专有的脂质纳米颗粒。“剂量可以调整、停止和间隔。洛克哈特说,与 AAV 相比,您可以更好地控制药物。
“两种系统都有利有弊,”伊格纳托娃说,并补充说,最好的系统可能取决于公司希望在哪里提供他们的 tRNA。
tRNA 领域的第三个未知数是新兴技术是否会被现有方法或其他尚未出现的方法所淘汰。例如,Shape 正在开发一种 RNA 编辑技术来纠正 mRNA 中的突变。ReCode 正在开发 mRNA 疗法来替代囊性纤维化中的断裂基因,该公司认为它可以通过脂质纳米颗粒提供。在最近比较了 ReCode 的抑制性 tRNA 和 mRNA 方法后,Lockhart 说 ReCode 将优先考虑 mRNA 治疗囊性纤维化。
囊性纤维化基金会希望将这两种技术和其他技术(例如基因编辑)保留在桌面上。“最终你永远不知道哪种方法会获胜,最好采用多种方法,”Skach 说。
即使一种方法可行,也不意味着它是实用的。例如,一种称为碱基编辑的 CRISPR 形式可以修复 DNA 中的单核苷酸突变,但这种方法需要针对每个独特的突变定制治疗方法,包括可以出现在基因不同位置的相同核苷酸开关。“我们可以为 Natasha 做这件事,但它不能推广,”Fischer 说。尽管他承认抑制型 tRNA 并非对所有情况都有效,但他认为对于需要精细调节的大基因突变引起的疾病,它仍然是最佳选择。“这就是我们与其他方法相比真正具有竞争优势的地方。”
“我们最初的目标是治愈 Dravet,”Fischer 说。现在,他的公司正在寻求将其 tRNA 工作扩展到其他类型的癫痫,并最终扩展到神经退行性疾病和精神疾病。学术科学家计划为失明的遗传形式、一种称为 Hurler 综合征的溶酶体贮积病,甚至一种由钠通道突变引起的自闭症形式开发抑制性 tRNA。
娜塔莎现年 12 岁,癫痫发作次数比以前少,但她在行走和控制自己的行为方面出现了问题。Fischer 说,“现在的大问题是她和她家人的生活质量”。他补充说,能够帮助她变得更加独立的东西将是天赐之物。一旦 Tevard 为 Dravet 完成其抑制性 tRNA 疗法的临床前研究,其合作伙伴 Zogenix 将负责临床试验。他不能说具体什么时候开始。“希望不久。”
- 遗传常识-纯合/杂合/半合子
- Dystrogen Therapeutics 研究性嵌合细胞疗法 DT-DEC01 治疗 Duchenne 肌营养不良症临床显示有显著的功能和生物标志物改进
- Sarepta 同时布局外显子跳跃、PPMO和DMD 基因治疗
- CureDuchenne 通过投资 Code BioTherapeutics 继续致力于下一代基因治疗
- 遗传性包涵体肌病的基因研究进展2019.05.025
- 糖皮质激素能延缓可行走DMD患者并发症发生
- 肌肉剪切波弹性成像可用于监测 DMD 进展
- 新报告显示 2021 年罕见病药物开发资金同比增长 28%
- 揭开药品价格的神秘面纱
- 跳跃基因的适应将CRISPR-Cas基因写入技术推向新高度

至爱微信服务号

全部评论