重要进展:辉瑞罕见病日前更新基因疗法试验信息
本文转自 健点子公众号,原文链接:重要进展:辉瑞罕见病日前更新基因疗法试验信息
本周一,辉瑞公司更新了有关基因疗法治疗罕见病的最新进展。
根据临床试验数据库Clinicaltrials.gov的数据显示,辉瑞宣布,这个治疗罕见肌肉退行性疾病的基因疗法即将进入三期临床试验。
利用迷你肌营养不良蛋白作为治疗手段的PF-06939926将在春季或夏初进入临床三期。
虽然具体的时间表仍在确定中,但是,这是最新的表明,这个基因治疗将继续推进。
与此同时,辉瑞还提供了入组三期临床试验的标准。
这些标准中关键指标包括:
入组是年龄为4至7岁的男孩
通过先前认证的临床基因测试确诊杜氏肌营养不良(DMD)
使用稳定、每日剂量的糖皮质激素治疗 3 个月(泼尼松或是地夫可特)
这个三期临床试验,将是一个随机,双盲,安慰剂对照研究。这个三期临床试验的启动,将是辉瑞有望将这个基因疗法申报上市的关键一步。
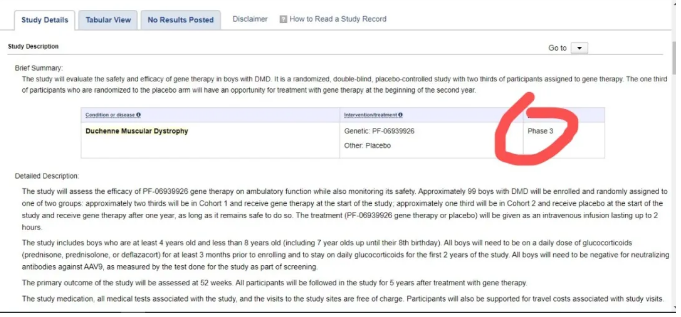
(Clinicaltrails.gov显示辉瑞基因疗法即将进入三期试验)
辉瑞公司表示,将继续就相关信息与社区分享。
据健点子的报道显示,PF-06939926是一个利用腺相关病毒血清型9(AAV9)作为载体,是一种基因替换治疗。
在新年伊始的一月份公司季报中,公司高管表示,辉瑞是基因疗法的坚信者和粉丝,公司计划在下半年进入三期临床试验。
此前的临床二期结果,在去年6年公布,显示,6名患者使用PF-06939926的治疗,该疗法显示了关于表达肌肉纤维相当于微营养不良症的令人鼓舞的数据。
在随后的半年时间内,辉瑞表示,“自那以后,我们又为病人加了剂量。我们继续获得在疗效、安全性和临床管理方面的经验,这些经验已纳入我们今后如何管理这些患者的程序中。”这位辉瑞全球研发总裁表示。
辉瑞还表示,将不断更新这个基因疗法的信息。
是的,我们辉瑞是基因治疗的粉丝
-- 辉瑞公司全球研发总裁
Mikael Dolsten
据最新的临床试验信息显示,这个临床试验将招募99名患者,将被登记并随机分配到两组之一:
大约三分之二(66人)将进入第一队列(Cohort 1),并在研究开始时接受基因治疗。
大约三分之一将在第二队列(Cohort 2)接受安慰剂。并在研究开始一年后接受基因治疗。
这个治疗(PF-06939926基因疗法或安慰剂)将作为静脉输注进行长达2小时的注射。
而在去年6月的PPMD会议上,辉瑞公司负责基因疗法研发的Binks博士表示,基因疗法面临突破的前夜。
“辉瑞相信,基因治疗作为一个坚实的治疗方法,治疗许多种单基因遗传病正处于一个即将突破的前夕,这也是我们罕见病的一个重点。”Binks博士表示道。
辉瑞的最新重磅消息,无形中对于另一家基因疗法的开发药企,萨雷普塔Sarepta公司来说是一个压力。
要知道,Sarepta公司近期和罗氏达成协议,要和罗氏合作在全球商业化自己的基因疗法,因此,下一步如何布局,如何和辉瑞同台竞技,请持续关注我们的后继跟踪更新。
参考链接
临床信息链接: 评估PF-06939926治疗Duchenne肌营养不良症的安全性和有效性的3期研究
PPMD资讯: 辉瑞分享有关PF-06939926基因治疗试验
健点子
- 遗传常识-纯合/杂合/半合子
- Dystrogen Therapeutics 研究性嵌合细胞疗法 DT-DEC01 治疗 Duchenne 肌营养不良症临床显示有显著的功能和生物标志物改进
- Sarepta 同时布局外显子跳跃、PPMO和DMD 基因治疗
- CureDuchenne 通过投资 Code BioTherapeutics 继续致力于下一代基因治疗
- 遗传性包涵体肌病的基因研究进展2019.05.025
- 糖皮质激素能延缓可行走DMD患者并发症发生
- 肌肉剪切波弹性成像可用于监测 DMD 进展
- 新报告显示 2021 年罕见病药物开发资金同比增长 28%
- 揭开药品价格的神秘面纱
- 跳跃基因的适应将CRISPR-Cas基因写入技术推向新高度

至爱微信服务号


全部评论