总部位于多伦多的生物科技公司 Satellos Bioscience 日前宣布,其新型小分子药物 SAT-3247 在一项开放标签的1b期临床试验中表现出良好的安全性与初步疗效。
该试验共招募 5位年龄在20–27岁之间的成年男性DMD患者,所有人都在使用处方类固醇治疗。试验为期28天,主要观察药物的安全性和耐受性,并探索其可能的疗效信号。
试验核心结果如下:
- SAT-3247在所有患者中均安全耐受,无严重不良反应;
- 药物的药代动力学(PK)表现与预期一致,即便在使用类固醇的患者中;
- 使用标准化的 MyoGrip装置测量握力,发现参与者的平均握力从约2公斤提升至4公斤,显示出潜在改善趋势;
- 其他功能指标保持稳定。
Satellos联合创始人兼CEO Frank Gleeson 表示:“尽管治疗时间仅28天,患者肌肉本就所剩不多,我们仍在握力上观察到了改善趋势。这与我们之前在啮齿类和犬类动物模型中所见的提升相符,预示该药物可能具备临床意义。”
目前,公司计划开展一项 为期11个月的长期随访研究,预计将在2025年第三季度开始,已获得澳大利亚伦理审批。后续研究将结合MRI评估肌肉变化,并每三个月测量握力,看效果能否持续。
此外,Satellos计划在完成更多数据分析与监管沟通后,正式启动一项二期安慰剂对照试验,目标人群将转向DMD儿童患者,预计于 2025年第三季度提交全球临床申请。
SAT-3247 是由 Satellos 公司自主研发的一种口服小分子新药,旨在促进Duchenne型肌营养不良(DMD)及其他肌肉退行性疾病或损伤状态下的骨骼肌再生。这款药物的特点在于,它的作用机制不依赖于肌萎缩蛋白(dystrophin),也不受外显子突变类型的限制,因此理论上适用于更广泛的DMD患者人群。
资讯来源:
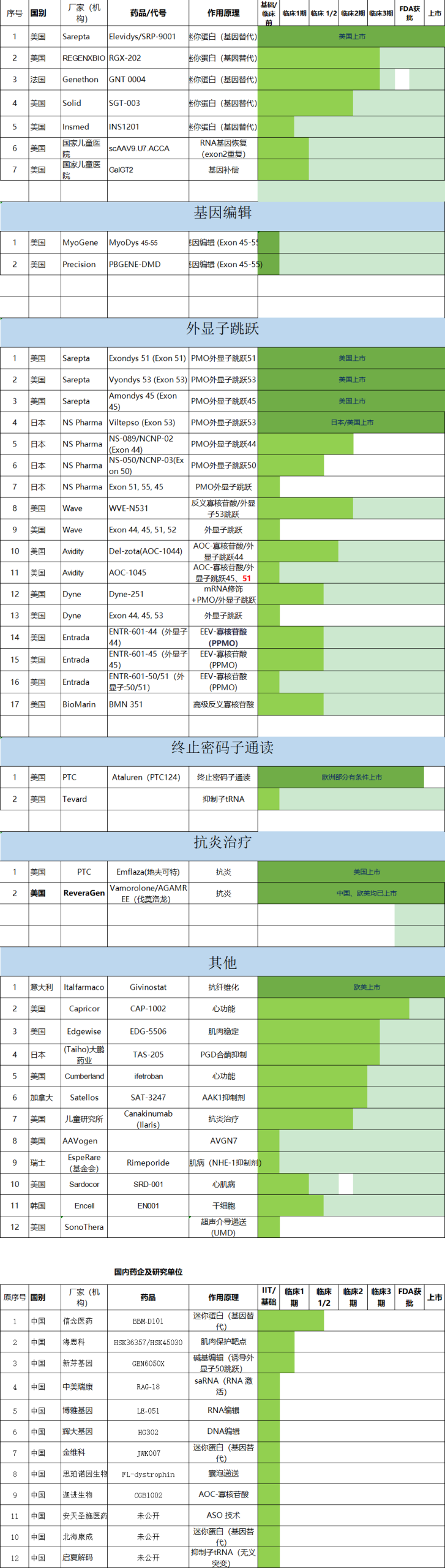
CureDuchenne社区报道:由于 PGN-EDO51 在其CONNECT1试验中未能达到目标抗肌萎缩蛋白水平,PepGen 已经结束了 PGN-EDO51 的临床试验,PGN-EDO51 是他们针对可跳过外显子 51 的杜氏患者的研究性疗法。
该公司打算逐步停止所有与 DMD 相关的研发活动。虽然这是一个令人失望的结果,但我们要感谢 CureDuchenne 为其提供早期资助的 PepGen,感谢他们开发 PGN-EDO51 并试图改善杜氏症患者的生活。
资讯来源:思索新知 PepGen终止DMD药物PGN-EDO51研发
2025 年 5 月 5 日 (GLOBE NEWSWIRE) — Capricor Therapeutics宣布完成与美国食品和药物管理局 (FDA) 就该公司的生物制品许可申请 (BLA) 举行的中期审查会议,寻求完全批准研究性细胞疗法 deramiocel, 作为诊断为杜氏肌营养不良症 (DMD) 心肌病患者的治疗方法。在会议期间,FDA 表示,审查委员会尚未发现任何重大缺陷,并且该一揽子计划有望在 2025 年 8 月 31 日实施《处方药使用者费用法案》(PDUFA) 行动。FDA 还确认了召开咨询委员会会议的意图,尽管尚未确定正式日期。
“我们的中期审查会议的成功完成以及即将召开的咨询委员会会议代表了 deramiocel 获得批准道路上的重要里程碑,”Capricor 首席执行官 Linda Marbán 博士说。Deramiocel是一种一流的细胞疗法,有可能阻止或减缓DMD心肌病的进展,我们很高兴有机会向咨询委员会提交疗效和安全性数据。我们一直在积极筹备咨询委员会会议,我们期待着为医生和患者提供观点,以强调支持 deramiocel 在治疗 DMD 心肌病方面的变革潜力的证据的重要性。
BLA 提交得到了 Capricor的 2 期 HOPE-2 和 HOPE-2 开放标签扩展 (OLE) 试验的心脏数据的支持,这些数据与 FDA 资助和已发布的关于 DMD 心肌病自然病自然病程和疾病进展潜在生物标志物的患者水平数据相比。正在进行的 HOPE-3 研究的疗效不属于此 BLA 包提交的一部分。
4、Entrada Therapeutics 获得欧盟授权,开始DMD外显子 45 跳跃临床试验
– 公司有望在 2025 年第三季度开始实施 ELEVATE-45-201 临床试验–
– 继最近在英国获得药品和保健产品监管局对 ELEVATE-45-201 的授权之后 –
波士顿,2025 年5 月28 日 (GLOBE NEWSWIRE) Entrada Therapeutics, Inc.(纳斯达克股票代码:TRDA)今天宣布,它已根据欧盟临床试验法规 (EU-CTR) 获得多个国家卫生当局和伦理委员会的授权,以启动 ELEVATE-45-201,这是 ENTR-601-45 在适合外显子 45 跳跃的杜氏肌营养不良症 (DMD) 患者中的 1/2 期多次递增剂量 (MAD) 临床研究。
Entrada Therapeutics首席执行官Dipal Doshi表示:“ELEVATE-45-201是针对适合外显子45跳跃的个体的偶联外显子跳跃疗法的最先进的临床研究,有可能解决具有重大未满足医疗需求的大量杜氏亚群。“欧盟的授权建立在我们新颖的 Duchenne 项目背后不断增长的临床势头之上。随着 ELEVATE-44 和 ELEVATE-45 的最近授权,以及计划在今年晚些时候提交 ELEVATE-50 申请,我们有望在年底前大幅扩大 DMD 特许经营的范围。
ELEVATE-45-201 是一项全球性的、分为两部分的随机、双盲安慰剂对照的 1/2 期研究,旨在评估 ENTR-601-45 在外显子 45 跳跃的杜氏门诊患者中的安全性、耐受性和有效性。A 部分是一项多次递增剂量研究,旨在评估大约 24 名患者的安全性、药代动力学和药效学,包括外显子跳跃和抗肌萎缩蛋白的产生。给药将每六周给药一次,三个队列的计划剂量预计从 5 mg/kg 到 15 mg/kg 不等。该研究的 B 部分将进一步评估 A 部分中确定的安全性和有效性的最佳剂量,包括功能结果和患者报告的生活质量指标。研究参与者可能有资格参加开放标签扩展研究 (OLE),其中 ENTR-601-45 的安全性、有效性和耐受性将在更长的时间内进行评估。公司有望在 2025 年第三季度启动 ELEVATE-45-201。
查看资讯来源:DMD海外信息 Entrada Therapeutics 获得欧盟授权,开始杜氏肌营养不良症的外显子 45 跳跃临床试验
![图片[1]DMD, 肌营养不良,肌肉萎缩,杜氏肌营养不良5月DMD药物最新进展(国际)DMD, 肌营养不良,肌肉萎缩,杜氏肌营养不良至爱杜氏肌营养不良关爱中心](https://www.china-dmd.org.cn/wp-content/uploads/2025/05/image-4.png)
加利福尼亚州纽波特海滩和加拿大埃德蒙顿(2025 年 5 月 22 日)– CureDuchenne Ventures 宣布对 Entos Pharmaceuticals Inc (Entos) 进行 $1M 的初始投资,Entos Pharmaceuticals Inc (Entos) 是一家生物技术公司,利用其非病毒、可重复的 Fusogenix PLV 交付平台开发基因药物。Entos 将利用这笔资金创建一种肌肉靶向疗法,以提供全长抗肌萎缩蛋白用于治疗杜氏肌营养不良症 (DMD)。
Entos 的 Fusogenix PLV 平台是一种结合了病毒和非病毒方法最佳方面的递送系统。Fusogenix PLV 使用一种全新的 RNA、DNA 和基因编辑疗法的细胞内递送机制,适用于各种一流的基因药物。Entos 致力于利用这项技术来开发治疗方法并改善患者及其家人的生活。
Entos 将在 5 月 22 日至 25 日在德克萨斯州圣安东尼奥举行的 CureDuchenne 2025 FUTURES 全国会议上与家人分享有关该平台及其在杜兴的计划的信息。该会议将于美国中部时间 5 月 23 日星期五上午 11:50 举行,并将进行现场直播。
“我们对 Entos Pharmaceuticals 技术的潜力感到非常兴奋,并期待与 Entos 合作,寻求一种克服当前基于 AAV 的方法局限性的基因疗法——一种不会排除具有预先存在免疫力的个体,允许重新编码,并且至关重要的是,将全长抗肌萎缩蛋白输送到所有必要的肌肉组织,“CureDuchenne 的创始人兼首席执行官 Debra Miller 说。CureDuchenne 长期以来一直是资助创新治疗方法的领导者,这项投资突显了我们持续利用风险慈善事业来促进 Duchenne 的变革性治疗进展。我们向我们的捐助者和 Duchenne 社区表示衷心的感谢——您的支持使这项投资成为可能,并继续推动治愈的进展。
“Fusogenix PLV 平台能够将全长功能基因(如抗肌萎缩蛋白)安全、有效且可重复地递送到全身的肌肉细胞。鉴于基于 Fusogenix PLV 的治疗可以多次进行,如果需要,这可能会真正改变游戏规则,“Entos Pharmaceuticals 首席执行官 John Lewis 说。“我们希望这种方法能对杜氏肌营养不良症患者及其家人产生真正的影响。”
关于 Entos Pharmaceuticals Inc
基因医学的新现实摆在面前,随着安全、有效和可重复核酸递送技术的出现,这一现实将迎来。自 2016 年成立以来,Entos® 一直致力于使用我们专有的 Fusogenix™ PLV™ 药物递送系统推进下一代基因药物。Fusogenix PLV 平台由 FAST 蛋白配制而成,能够通过直接融合将核酸递送至靶细胞。Entos 正在率先为患者开发改变生活的药物,并与 Eli Lilly 等全球公司合作,以加速和扩大我们平台的影响力。Entos Pharmaceuticals Inc. 总部位于加拿大埃德蒙顿,其美国和英国全资子公司分别位于加利福尼亚州圣地亚哥和英国伦敦。